정문국 / 와세다대 응용화학공학과 박사과정
배터리는 충·방전 가능 유무에 따라 크게 1차전지와 2차전지로 나뉘며, 사용되는 재료에 따라 다양한 특징의 배터리가 만들어진다. 여러 종류의 배터리들은 사용기기의 목적에 따라 선택되어 실생활에 적용된다. 공학적인 용어로 배터리를 정의하자면 ‘전기화학적 원리에 의해 작동하는 에너지 저장 디바이스’라고 말할 수 있다. 현재 많은 종류의 배터리가 존재하지만 작동원리는 기본적으로 ‘전기화학 반응’의 동일한 메커니즘에 의해 이루어진다. 아마도 독자에게는 매우 생소할 이 단어는 ‘전기’와 ‘화학’이라는 익숙한 단어로 이루어져있다. 다시 말해, 화학반응으로 전기를 만들고, 전기를 이용해 화학반응이 일어나게 하는 원리로 작동하는 것이다.
전기 + 화학 = 전기화학?
이 글을 읽고 있는 지금 이 순간에도 우리는 전기를 사용하고 있다. 인터넷으로 이 기사를 보기 위해 컴퓨터를 켠 독자도 있을 것이고, 지면으로 읽는 독자는 방을 밝히기 위해 전등을 켜놓았을 것이다. 뿐만 아니라 신문을 보며 커피를 마시기 위해 물을 끓일 때에도 전기포트를 이용한다. 우리는 화학이라는 학문을 초등학교 때부터 배워왔다. 예를 들어, 바닷물을 가열하면 소금이 남는 실험을 통해 혼합물의 분리를 배웠고, 우유, 간장, 식초, 비눗물 등을 가지고 산과 염기에 대해서 배웠다. 그렇다면 ‘전기’와 ‘화학’은 어떤 관련이 있는 것일까?
전기화학이 무엇인지 얘기하기 전에 우선적으로 알아야 할 과학 용어들에 대해 설명해 보자. 중·고등학교 화학 시간을 추억해 보면 ‘원자/원소’에 대해 공부했던 것을 기억 할 것이다. 원자/원소란 세상에 존재하는 물질들의 가장 기본 단위가 되는 최소 입자를 말한다. 즉, 세상의 모든 물질을 쪼개고, 자르고, 분해하다 보면 원자/원소라는 최소입자를 만나게 된다. 가장 쉬운 예로, 물을 화학적 기호로 표시하면 H2O가 되며, 이것은 수소(H)와 산소(O)라는 물질이 결합하고 있다는 의미가 된다. 이때 수소 및 산소를 원자/원소라고 말한다. 다른 예로, 주변에서 쉽게 볼 수 있는 음료수 페트병(PET)을 얘기해 보자. PET는 Polyethylene phthalate라는 화학적 이름의 약자로서, 화학 기호로는 (C10H8O4)n으로 쓴다. 간단하게 말하자면 모든 페트병은 탄소(C), 수소(H), 산소(O)가 적절한 비율로 결합하여 만들어진 화학 물질이다. 이외에도 이 세상에는 총 118개의 원자/원소들이 존재하며, 그 중 92개는 자연 상태에 ‘스스로’ 존재하고 있다. 이 원자/원소들이 화학적 결합을 통해 세상만물을 이루고 있는 것이다.
다음으로 전하에 대해서 설명해보자. 전하란 물체가 띠고 있는 정전기의 양으로서 모든 전기현상의 근원이 된다. 책받침을 비벼서 머리에 대면 머리카락이 붙는다거나, 건조한날 문고리를 잡거나 스웨터를 입을 때 순간적으로 따끔한 무언가를 느껴본 경험이 있을 것이다. 이 모든 것이 전하를 띠는 입자들 때문에 발생하는 현상들이다. 모든 물질은 음전하와 양전하가 균형을 이뤄 중성을 띠고 있을 때 가장 안정적이지만, 물질들 간에 존재하는 힘의 차이로 인해 각 전하들이 불균형하게 존재할 때가 있으며, 이 때 전기량을 가지게 된다. 원자와 전하의 관계는 전자를 통해서 설명할 수 있는데, 전자란 원자를 이루는 구성요소 중 하나이다. 전자는 음전하를 가지는 질량이 매우 작은 입자로서 화학용어로는 e-로 표시한다. 중성 상태의 원자가 외부의 힘에 의해 전자를 잃거나 얻으면 이온의 형태가 된다. 즉, 원자가 전자를 잃으면 양이온, 얻으면 음이온의 상태가 되며, 양이온의 상태에서는 전자를 받아서, 음이온의 상태에서는 전자를 잃어서, 다시 중성의 상태로 돌아가려는 성향을 가지게 된다. 이러한 과정을 산화·환원이라고 말한다.
산화와 환원의 사전적 의미는 다음과 같다. ‘산화(oxidation): 협의로는 물질이 산소와 화합하는 것을 말하지만, 일반적으로는 널리 전자를 빼앗기는 변화 또는 그것에 따르는 화학변화’를 가리킨다. ‘환원(reduction): 산화의 역반응’을 말한다. 일반적인 좁은 의미로는 수소가 가해지는 것 또는 산소를 주는 경우를 말하지만, 넓게는 전자를 얻었을 때 환원된다. 일상생활에서 쉽게 볼 수 있는 산화 반응은 못에 녹이 스는 과정이다. 금속이 오랜 시간 동안 공기 중에 노출되면 산소와 반응해 녹이 스는 것을 볼 수 있다. 이때 비가 오거나 습기가 가해지면 더 빨리 녹이 스는 경우도 있다. 이것은 모두 금속이 가지고 있는 전자, 전하 등이 중성을 이루지 못하고 공기중의 산소와 반응을 하게 되어 산화 상태가 되는 것을 말한다.
위의 용어들을 잘 이해하였다면 다시 전기화학으로 돌아가 보자. 먼저 화학에너지란 원자들이 산화·환원되는 과정에서 발생하거나 흡수되는 에너지를 말한다. 예를 들어, 우리가 밥을 먹으면 몸 속으로 들어간 음식물은 고유의 화학구조가 분해 또는 변화하여 에너지를 발생하게 되고, 우리의 몸은 그 에너지를 소비하면서 힘을 내게 된다. 이러한 화학에너지가 빛의 형태로 발현이 되면 빛에너지, 열의 형태로 발현이 되면 열에너지로 변환되는 것이다. 전기에너지란 앞에서 설명한 화학에너지가 전기의 형태로 변환되어 소비되는 것을 말한다. 이 두 가지 영역에서 일어나는 현상들을 함께 다루는 것이 전기화학이다. 즉, 배터리는 물질의 화학적 변화가 일어나면서 에너지가 발생하고, 그 에너지를 전기형태로 소비하는 과정 또는 외부 전력원, 충전기에 연결된 콘센트 등으로 부터 전기에너지를 받아 내부 물질의 화학 상태를 변화시켜 에너지를 저장시키는 과정을 이용하는 에너지 저장장치를 말한다.
배터리, 그리고 리튬 2차전지
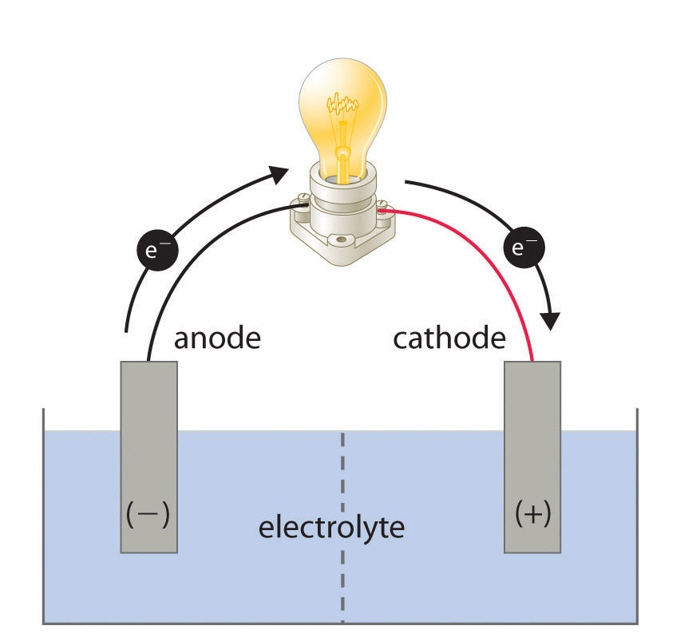
조금 더 자세하게 배터리의 구조, 배터리의 원리, 전기와 화학에너지가 변환되는 과정을 살펴보자. 배터리는 기본적으로 두 개의 서로 다른 전극과 전해질로 구성되어 있다. 보통 전극은 종류가 다른 두 개의 금속을, 전해질은 이온이 쉽게 이동할 수 있는 액체상의 물질을 이용한다. 전지의 기본적인 전기화학 반응을 위의 그림1을 보며 설명해보자. 두 종류의 다른 금속을 액체 전해질에 담그면 기본적인 배터리의 구조를 가지는 셀이 만들어진다. 이 상태에서는 물질들 간에 산화·환원 반응이 일어나지 않는 안정한 상태로 존재하지만, 두 전극을 전선으로 이어주면 전극 간에 생기는 화학적 힘의 차이 때문에 화학반응이 시작된다. 한 전극이 반대쪽 전극에 의해 전자를 뺏겨 잃어버리게 되면, 그 금속전극과 전해질이 접촉하고 있는 장소에서 산화반응이 일어나 이온이 만들어지고 불균형 상태가 돼버린다. 한편, 반대쪽 전극에서는 빼앗은 전자를 얻음과 동시에 불균형 상태의 이온이 환원반응을 일으킨다. 이러한 산화·환원 반응을 통해 에너지가 발생하게 되며, 이 때 외부 전선에 전구를 연결하면 전기가 통하여 불이 들어오는 것이다. 전극, 전해질로 사용하는 물질에 따라 배터리가 가지는 성능은 다양하게 변화될 수 있으며, 사용하는 장비들의 목적에 맞게 배터리를 선택 적용하게 된다.
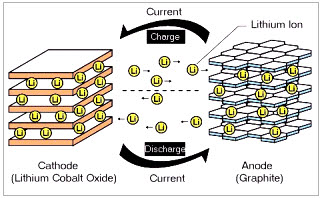
리튬이온 전지에서 일어나는 전기화학반응을 위의 그림2와 함께 설명하며 마치도록 하자. 현재 상용화된 리튬이온전지의 경우, 전이금속산화물과 흑연을 두 전극으로 사용한다. 이 두 전극을 리튬이온이 포함된 유기용액 전해질에 분리막과 함께 함침시켜 전지를 만들면 약 3.6-3.8V의 전압을 가진 리튬 이온 배터리가 완성된다. 두 전극간의 힘의 차이로 인해외부 도선을 통해 전자가 (-)극에서 (+)극으로 이동을 하게 된다. 그와 동시에 (-)극과 반응하고 있던 리튬은 전자를 잃게 되어 양이온(리튬 이온, Li+)으로 변한다. 배터리 내부의 전체적인 화학적 평형을 이루기 위해 리튬이온은 전해질을 통해 (+)극으로 이동하고, (+)극 물질과 반응하며 안정하게 된다. 이러한 일련의 과정에서 전기 에너지를 발생시켜 핸드폰, 노트북 등의 기계를 작동시킬 수 있는 것이다. 이 때, 두 전극 사이를 오가는 물질로 리튬을 사용하기 때문에 리튬 2차전지라고 부르는 것이다.
